網頁維護:蔡仁傑
更新日期:2020/04/07
實驗室簡介 |
|
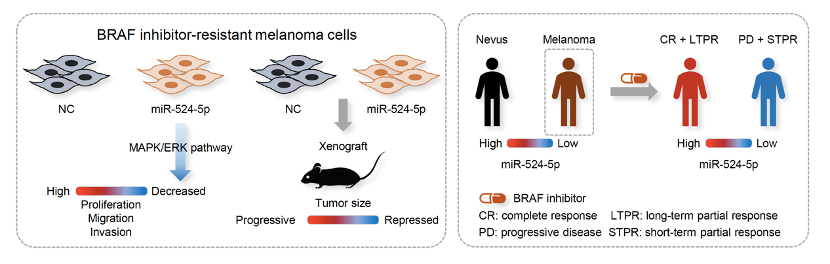
馬念涵老師實驗室研究微型RNA (miRNA) 對於黑色素瘤 (melanoma) 的分子機制,熊本大學Satoshi Fukushima等三位教授長期致力於臨床皮膚疾病研究並收集許多日本病患檢體, 兩方因而共同合作發現微型miR-524-5p的表現量可以作為摽靶治療BRAF抑制劑用於黑色素瘤患者反應的預後標記並與治療抗性有關, 此成果已在今年發表在Neoplasia 期刊上,未來將繼續共同探討微型RNA在黑色素瘤之免疫治療新領域中的作用及將其應用於臨床上偵測疾病及治療方面。 |
 |
我們實驗室致力於了解癌症的分子機制,疾病的生理模式以及將其應用於臨床治療。在過去幾年間,我們實驗室成功建立了強而有力的系統性的訊息傳導篩選平台,在此平台下,我們可以: |
1. 尋找重要的微型核醣核酸(miRNA)作為可能的治療疾病的標靶、追跡疾病或輔助診斷的疾病標記。 |
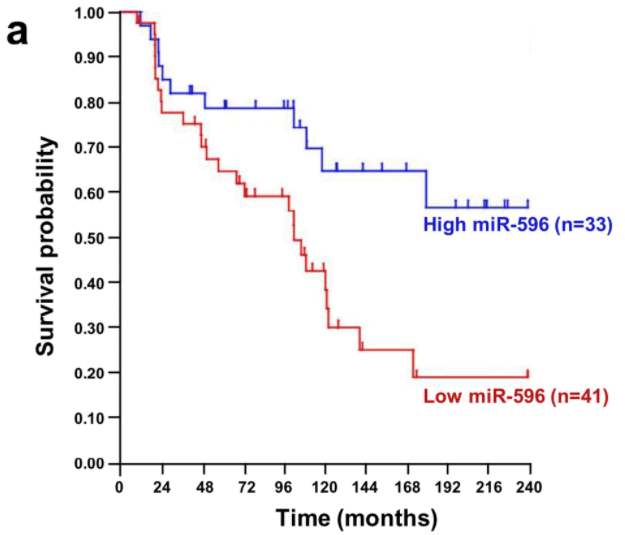
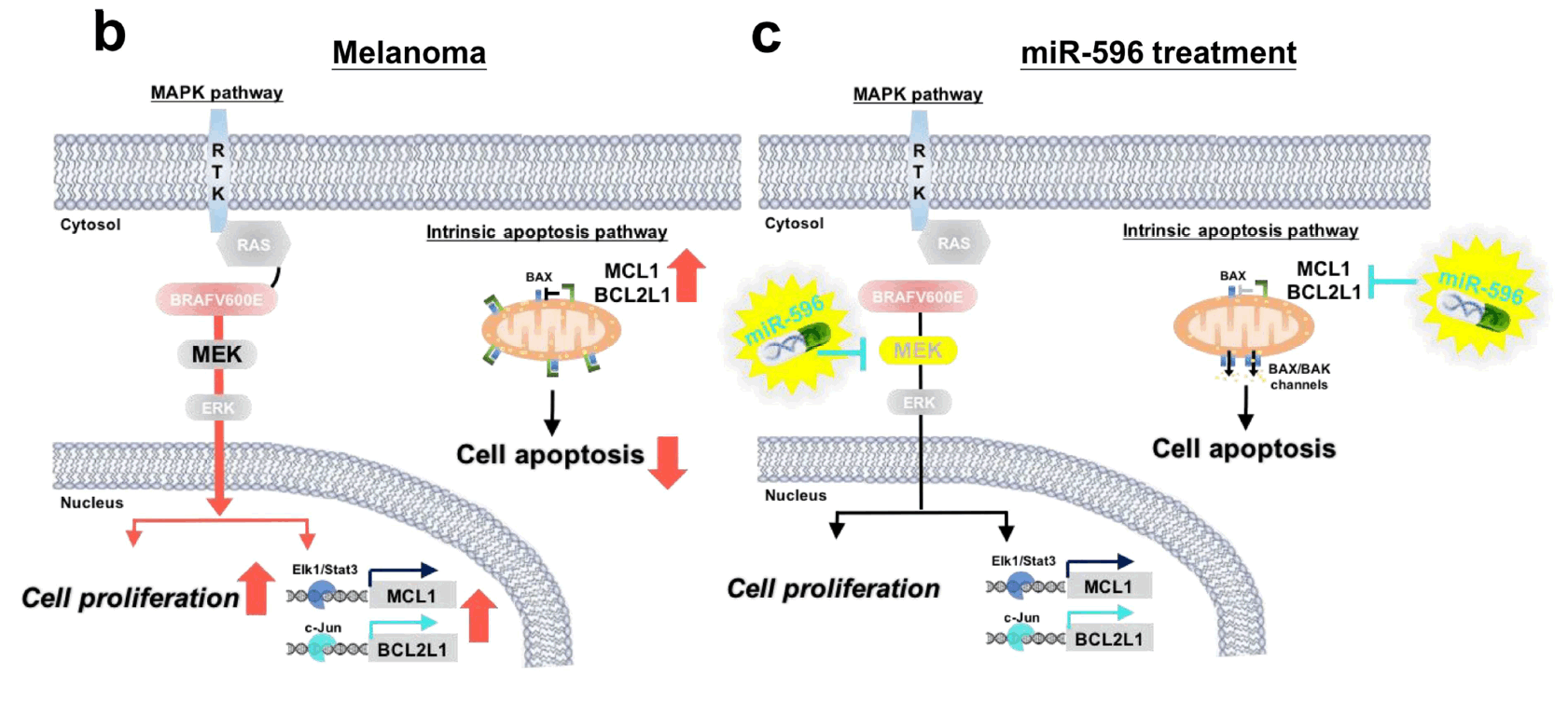
到目前為止,我們實驗室篩選了在MAPK/ERK pathway中具有特異性的微型核醣核酸並且發現其中的miR-524-5p可以調控MAPK/ERK pathway活性,並且mir-524-5p可以影響在黑色素瘤(melanoma)中MAPK/ERK pathway的兩個致癌蛋白(onco-proteins)的表現 (Liu et al., Oncotarget, 2014). 除此之外,我們也發現miR-596可以透過抑制MAPK pathway中的MEK1蛋白表現進而抑制MAPK pathway活性以及抑制細胞凋亡(Apoptosis)相關的蛋白質BCL2L1, MCL1的表現,進而抑制黑色素細胞的生長。(Liu et al., J Invest Dermatol, 2017) |
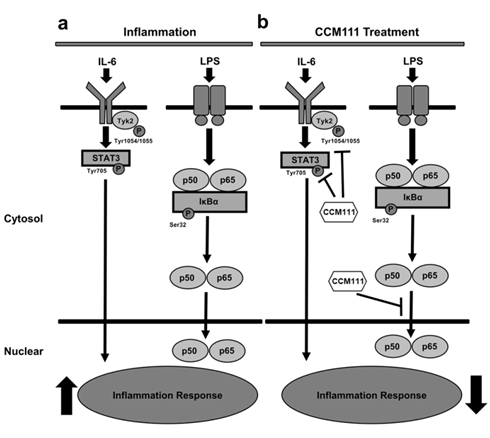
我們發現台灣特有的草藥在動物模式中可以抑制發炎反應並且更進一步的發現其分子機制是透過抑制NF-κB以STAT3兩個發炎反應的訊息傳導路徑進而抑制發炎反應。(Lin et al., Sci Rep. 2017)這類新的發現在癌症的轉譯醫學領域具有影響力,並且期待未來將會應用於臨床治療。 |
非常歡迎任何對於我們研究領域感興趣的人加入我們實驗室! |
 |
 |
研究目標 |
運用技術 |
● 診斷與預後的疾病標記 |
● 微型核醣核酸分析 |
研究主題簡介 |
|
1. 微型核醣核酸在訊息傳導路徑的機制 |
|
微型核醣核酸(miRNA)是一種非編碼的RNA序列,約19-25個核醣核酸構成。微型核醣核酸被發現可以透過轉錄後調控(post-transcription regulation)調控基因表現;到目前為止已有大量研究證實微型核醣核酸可以有效的調控與癌症相關的訊息傳導路徑,然而,到底微型核醣核酸是如何調控訊息傳導路徑仍然有很多未知的地方。 |
|
 |
|
 |
|
2. 牛樟芝的抗發炎反應機制 |
|
發炎反應是身體的先天防禦機制(innate immune system),當有外來病原體入侵時能夠快速反應並消除其威脅,然而,雖然發炎反應在我們身體的免疫機制中相當重要,但是發炎反應與很多疾病的發生有直接關係如癌症。發炎反應發生時會活化免疫細胞、分泌細胞激素以及促進修復反應。但是長期的發炎反應會造成細胞逐漸癌化,許多免疫細胞分泌出原本用於促進傷口癒合的血管新生激素與細胞增殖激素不但不會消滅癌細胞,反而會促使癌細胞生長。在發炎反應過程中,巨噬細胞在促進發炎的進程中扮演很重要的角色。 |
|
 |
|
由於發炎反應在肝纖維化的進程中扮演重要的角色,因此我們利用動物模型與細胞株來研究CCM111與肝纖維化之間的作用機制。在實驗結果中,我們發現CCM111可以減輕四氯化碳(CCl4)與二甲基亞硝胺誘導老鼠的肝纖維程度與降低肝臟損傷,有效的降低肝指數AST, ALT。 |
|
3. 探索與腫瘤放射線治療抗性相關之微型核糖核酸 |
|
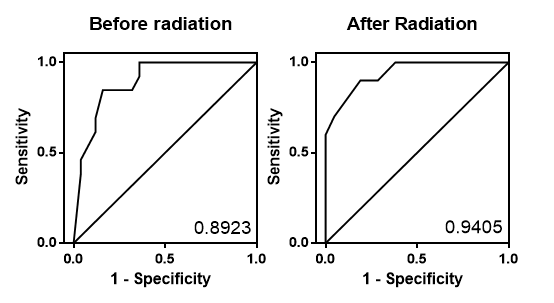
放射線治療,化學治療和手術是現今傳統的癌症治療方法。50%以上的癌症病患需要接受放射線治療,並且有部份的病人產生放射治療抗性,導致預後不良,其中包括腫瘤復發及轉移。若我們可以事先預測哪種治療方式是對病患有效的,治療成功率以及癌症病患的存活率便可增加。然而,仍然有非常多疑問無法解釋放射線治療為何效果不同,為何相似的腫瘤大小、狀態、程度與放射線劑量相同的情況下有些人的腫瘤會復發。因此在這種情形下,探討"放射線抗性腫瘤"訊息傳導路徑的失調與發展相關藥物更顯得重要。 |
|
 |
|
4. 探索微型核醣核酸作為慢性腎臟病人中得到泌尿道上皮細胞癌疾病標記的可能性 |
|
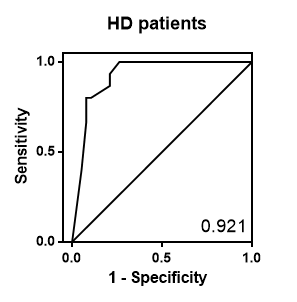
泌尿道上皮癌(Urothelial carcinoma, UC)是台灣泌尿系統特有型態的癌症,發生在慢性腎臟病 (Chronic kidney disease, CKD)病人3至5期由55%上升到71%,顯示UC的發生在的CKD族群有正向關係。截至2015年CKD全球盛行率為 8-16%,於2008年健康檢查資料發表的報告推估,台灣 CKD 全國盛行率為 11.9%,UC現行臨床所使用的診斷方式為腰痛、血尿等症狀,合併尿液細胞學與膀胱鏡檢查,然而這對早期的UC的發現是困難的,所以建立一個非侵入且簡單的檢測方式是需要的。 |
|
 |







